Гипохлорит натрия
ТУ 6-01-29-93
NaOCl
Гипохлорит натрия (натрий хлорноватистокислый) — NaOCl, неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода».
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
| Физические свойства | |
|---|---|
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574 г/см³; 1,1 |
| Термические свойства | |
| Т. плав. | NaOCl · 5H2O: 24,4 °C; NaOCl · 2,5H2O: 57,5 |
| Т. разл. | 5%-й раствор: 40 °C |
| Энтальпия образования | пентагидрат: − 350,4 кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4 |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9 |
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C).
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом.
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C.
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления: 24,4 °C (по другим данным: 18 °C), при нагревании (30—50 °C) разлагается.
Плотность водного раствора гипохлорита натрия при 18 °C
| Плотность, г/л | 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % |
|---|---|---|---|---|---|---|---|
| 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 | |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций
| Температура замерзания, °C | 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % |
|---|---|---|---|---|---|---|---|---|
| −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔHo298: −350,4 кДж/моль;
- стандартная энергия Гиббса, ΔGo298: −298,7 кДж/моль.
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом.
При нагревании параллельно происходит реакция диспропорционирования:
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537), гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11).
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом:
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования:
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме[15]:
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме[13]:
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде:
-
- в кислой среде:
 |
 |
 |
 |
-
- в нейтральной и щелочной среде:
 |
 |
 |
 |
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
-
- Иодиды щелочных металлов окисляются до иода (в слабокислой среде), иодата (в нейтральной среде) или периодата (в щелочной среде)[13]:
-
- сульфиты окисляются в сульфаты, нитриты в нитраты, оксалаты и формиаты в карбонаты и т. п.[13]:
-
- Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот[18]:[стр. 169]:
-
- Аммиак под действием гипохлорита натрия через стадию образования хлорамина, превращается в гидразин (аналогично реагирует и мочевина)[18]:[стр. 181]:
-
- Соединения металлов с низшими степенями окисления превращаются в соединения с высшими степенями окисления[18]:[стр. 138, 308][19]:[стр. 200]:
- По аналогии можно осуществить превращения: Fe(II) → Fe(III) → Fe(VI); Co(II) → Co(III) → Co(IV); Ni(II) → Ni(III); Ru(IV) → Ru(VIII); Ce(III) → Ce(IV) и прочие.
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n’-диокситрифенилметаном в присутствии бромата калия[21].
Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА) или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА) с использованием бром-ионоселективного электрода (Br-ИСЭ).
Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия).
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | — | твёрдый, влажный | 25 | > 10 мм/год |
| 10; pH>7 | водный раствор | 25 | > 10 мм/год | |
| Медь | 2 | водный раствор | 20 | < 0,08 мм/год |
| 20 | водный раствор | 20 | > 10 мм/год | |
| Медные сплавы: БрА5, БрА7, Л59, Л63, Л68, Л80, ЛО68-1 |
10 | водный раствор | 20 | > 10 мм/год |
| Никель | < 34 | водный раствор | 20 | 0,1—3,0 мм/год |
| Никелевый сплав НМЖМц28-2,5-1,5 | < 34; активный хлор: 3 | водный раствор | 20 | 0,007 мм/год |
| Никелевый сплав Н70МФ | < 34 | водный раствор | 35—100 | < 0,004 мм/год |
| Платина | < 34 | водный раствор | < 100 | < 0,1 мм/год |
| Свинец | < 34; активный хлор: 1 | водный раствор | 20 | 0,54 мм/год |
| 40 | 1,4 мм/год | |||
| Серебро | < 34 | водный раствор | 20 | < 0,1 мм/год |
| Сталь Ст3 | — | твёрдый, безводный | 25—30 | < 0,05 мм/год |
| 0,1; pH > 10 | водный раствор | 20 | < 0,1 мм/год | |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Сталь 12Х17, 12Х18Н10Т | 5 | водный раствор | 20 | > 10,0 мм/год |
| Сталь 10Х17Н13М2Т | < 34; активный хлор: 2 | водный раствор | 40 | < 0,001 мм/год |
| T кип. | 1,0—3,0 мм/год | |||
| Сталь 06ХН28МДТ | < 34 | водный раствор | 20—T кип. | < 0,1 мм/год |
| Тантал | < 34 | водный раствор | 20 | < 0,05 мм/год |
| Титан | 10—20 | водный раствор | 25—105 | < 0,05 мм/год |
| 40 | водный раствор | 25 | < 0,05 мм/год | |
| Цирконий | 10 | водный раствор | 30—110 | < 0,05 мм/год |
| 20 | водный раствор | 30 | < 0,05 мм/год | |
| Чугун серый | < 0,1; pH > 7 | водный раствор | 25 | < 0,05 мм/год |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Чугун СЧ15, СЧ17 | < 34 | водный раствор | 25—105 | < 1,3 мм/год |
| Асбест | 14 | водный раствор | 20—100 | стоек |
| Графит, пропитанный феноло-формальдегидным олигомером | 25 | водный раствор | Т кип. | стоек |
| Полиамиды | < 34 | водный раствор | 20—60 | стоек |
| Поливинилхлорид | < 34 | водный раствор | 20 | стоек |
| 65 | относительно стоек | |||
| Полиизобутилен | < 34 | водный раствор | 20 | стоек |
| 60 | относительно стоек | |||
| 100 | нестоек | |||
| Полиметилметакрилат | < 34 | водный раствор | 20 | стоек |
| Полиэтилен | < 34 | водный раствор | 20—60 | стоек |
| Полипропилен | < 34 | водный раствор | 20—60 | стоек |
| Резина на основе бутилкаучука | 10 | водный раствор | 20—65 | стоек |
| насыщенный | водный раствор | 65 | стоек | |
| Резина на основе натурального каучука | 10—30 | водный раствор | 65 | стоек |
| Резина на основе кремнийорганического каучука | любая | водный раствор | 20—100 | стоек |
| Резина на основе фторкаучука | < 34 | водный раствор | 20—93 | стоек |
| Резина на основе хлоропренового каучука | 20 | водный раствор | 24 | относительно стоек |
| насыщенный | водный раствор | 65 | нестоек | |
| Резина на основе хлорсульфированного полиэтилена | < 34 | водный раствор | 20—60 | стоек |
| Стекло | < 34 | водный раствор | 20—60 | стоек |
| Фторопласт | любая | водный раствор | 20—100 | стоек |
| Эмаль кислотостойкая | любая | водный раствор | < 100 | стоек |
| Т кип. | относительно стоек |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях.
Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Дрожжеподобные грибы, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия. Более резистентны к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-м раствором и через 30 минут после обработки 0,5%-м раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia[К 11], погибают в течение 15 секунд после обработки 5,0—0,5%-м раствором NaOCl.
Несмотря на высокую биоцидную активность гипохлорита натрия, следует иметь в виду, что некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза , устойчивы к его действию.
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов. В приведённой ниже таблице представлены результаты инактивации токсинов при 30-минутной экспозиции различных концентраций NaOCl («+» — токсин инактивирован; «−» — токсин остался активен):
| Токсин | 2,5 % NaOCl + 0,25 н NaOH |
2,5 % NaOCl | 1,0 % NaOCl | 0,1 % NaOCl |
|---|---|---|---|---|
| Т-2 токсин | + | − | − | − |
| Бреветоксин | + | + | − | − |
| Микроцистин | + | + | + | − |
| Тетродотоксин | + | + | + | − |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
На организм человека гипохлорит натрия может оказывать вредное воздействие. Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта.
Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу. Также подтверждено, что гипохлорит натрия не является мутагенным, канцерогенным и тератогенным соединением, а также кожным аллергеном. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов[31].
Пероральная токсичность соединения:
- Мыши: ЛД50 (англ. LD50) = 5800 мг/кг;
- Человек (женщины): минимально известная токсическая доза (англ. TDLo) = 1000 мг/кг.
Внутривенная токсичность соединения[32]:
- Человек: минимально известная токсическая доза (англ. TDLo) = 45 мг/кг.
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль, воду и кислород. Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах.
Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Рейтинг NFPA 704 для концентрированных растворов (10—20 %):
Лабораторные методы получения
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия:
Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой.
Вместо гидроксида для синтеза можно взять карбонат натрия:
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция[36]:
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», то есть на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд.
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
- химический метод — хлорирование водных растворов гидроксида натрия;
- электрохимический метод — электролиз водного раствора хлорида натрия.
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:
- основной процесс, где в качестве конечного продукта образуется разбавленный (около 16 % NaOCl) раствор гипохлорита с примесью хлорида и гидроксида натрия;
- низко-солевой или концентрированный процесс — позволяет получить концентрированный (25—40 % NaOCl) с меньшим уровнем загрязнения.
Химический метод
Сущность химического метода получения NaOCl не изменилась с момента его открытия Лабарраком
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте.
Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке
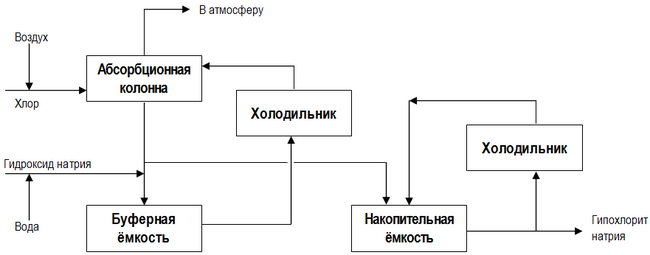
Низкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор (см. на рисунке), где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора

В России товарный гипохлорит натрия производят следующие предприятия:
- «Каустик», ЗАО (Стерлитамак);
- «Каустик», ОАО (Волгоград);
- «Новомосковский хлор», ООО (Новомосковск);
- «Сода-хлорат», ООО (Березники).
Электрохимический метод
Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами (бездиафрагменный способ), то есть продукты электролиза свободно смешиваются в электрохимическом процессе.
Процесс на аноде:
Процесс на катоде:
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Общая схема процесса:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных.
В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec.
Система Seaclor® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %.
Установки Sanilec® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день, концентрация активного хлора составляет 0,05—0,25 %.
Характеристика продукции, обращение, хранение и транспортировка
В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 «Гипохлорит натрия. Технические условия». В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже:
| Наименование показателя | Марка А | Марка Б |
|---|---|---|
| Внешний вид | Жидкость зеленовато-жёлтого цвета | |
| Коэффициент светопропускания | Не менее 20 % | |
| Массовая концентрация активного хлора, г/дм³, не менее | 190 | 170 |
| Массовая концентрация щёлочи в пересчёте на NaOH, г/дм³ | 10—20 | 40—60 |
| Массовая концентрация железа, г/дм³, не более | 0,02 | 0,06 |
| Область применения | В химической промышленности для обеззараживания воды, дезинфекции и отбелки | В витаминной промышленности (как окислитель) и для отбеливания ткани |
Гипохлорит натрия должен храниться в защищённых от света, специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90 % объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Растворы товарного гипохлорита натрия со временем теряют свою активность из-за разложения NaOCl. Следующая таблица наглядно показывает, что с течением времени концентрация активного вещества в растворах уменьшается. Тем не менее, как видно из полученной диаграммы, с уменьшением концентрации гипохлорита скорость его распада также уменьшается и промышленные растворы стабилизируются:
| Концентрация NaOCl, % | Период полуразложения, дней | |
|---|---|---|
| 25 °C | 35 °C | |
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Наиболее стабильны для хранения водные растворы гипохлорита, имеющие pH в диапазоне 11,86−13.
Применение
Водный растворр гипохлорита натрия применяют при дезинфекции, так как обладает высокой антибактериальной активностью при воздействия на разные микроорганизмы.
Гипохлорит натрия используется для:
- для обработки питьевой воды и воды бассейнов для плавания;
- в химической пром-сти для производства средств для отбеливания;
- для дезинфекции сточных вод;
- как окислитель при отбеливании тканей;
- для обеззараживания воды рыбохозяйственных водоёмов, так как раствор гипохлорит анатрия убивает все виды болезнетворных агентов;
- для обработки помещений на предприятиях общепита и в медучреждениях;
































